
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
| A | B | C | D |
 |
 |
 |
 |
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
| 編號 | 反應(yīng)條件 | 反應(yīng)速率 |
| (1) | 加入催化劑 | |
| (2) | 將容器容積擴大為原來2倍 | |
| (3) | 保持體積不變通入b mol Ne(g) |
查看答案和解析>>
科目: 來源: 題型:
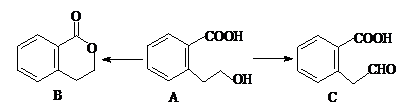
查看答案和解析>>
科目: 來源: 題型:
| ||
查看答案和解析>>
科目: 來源: 題型:
 (1)將鋅片和銀片用導(dǎo)線相連浸入稀硫酸中組成原電池.該電池中負極發(fā)生
(1)將鋅片和銀片用導(dǎo)線相連浸入稀硫酸中組成原電池.該電池中負極發(fā)生查看答案和解析>>
科目: 來源: 題型:
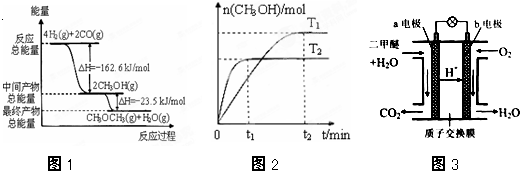
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com