運用化學反應(yīng)原理研究氮�����、硫��、氯等單質(zhì)及其化合物的反應(yīng)有重要意義.
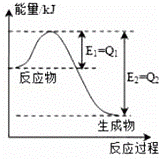
(1)氮是地球上含量豐富的一種元素�,氮及其化合物在工農(nóng)業(yè)生產(chǎn)、生活中有著重要作用�,如圖是一定的溫度和壓強下N2和H2反應(yīng)生成lmolNH3過程中能量變化示意圖,請寫出工業(yè)合成氨的熱化學方程式: (△H的數(shù)值用含字母Q1、Q2的代數(shù)式表示).
(2)硫酸生產(chǎn)中�,SO2催化氧化生成SO3:2SO2(g)+O2(g)⇌2SO3(g),混合體系中SO3的體積分數(shù)和溫度的關(guān)系如圖1所示(曲線上任何一點都表示平衡狀態(tài))���,根據(jù)圖示回答下列問題�,
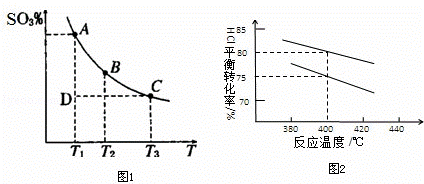
①2SO3⇌2SO2+O2的△H 0.
②若溫度為T1�、T2,反應(yīng)的平衡常數(shù)分別為K1�,K2,則K1 K2��;
③反應(yīng)進行到狀態(tài)D時�,v正 v逆(填<、>或=).
(3)Cl2合成有機物時會產(chǎn)生副產(chǎn)物HC1.4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)可實現(xiàn)氯的循環(huán)利用.
①該反應(yīng)平衡常數(shù)的表達式K= �;若反應(yīng)容器的容積為2L,4min后達到平衡���,測得容器內(nèi)物質(zhì)由2.5mol減少至2.25mol���,則HCl的平均反應(yīng)速率為 mol/L∙min.
②若該反應(yīng)在體積不變的密閉容器中發(fā)生,當反應(yīng)達平衡時���,下列敘述正確的是 .
a.4v正(HCl)=v逆(O2)
b.又加入1mol O2����,達新平衡時,HCl的轉(zhuǎn)化率增大
c.分離出H2O����,達新平衡時,v正(HCl)增大
③圖2是該反應(yīng)兩種投料比[n (HCl):n (O2)分別為4:1和2:1下��,反應(yīng)溫度對HCl平衡轉(zhuǎn)化率影響的曲線.下列敘述正確的是 .
a.其他條件不變�����,升高溫度�,平衡常數(shù)K值增大
b.若平衡常數(shù)K值變大���,達新平衡前v逆始終減小
c.若平衡常數(shù)K值變大��,則平衡向正反應(yīng)方向移動
④投料比為4:1����、溫度為400℃時���,平衡混合物中
Cl2的物質(zhì)的量分數(shù)是 %.(計算結(jié)果保留一位小數(shù))