
題目列表(包括答案和解析)
 以下是某實驗小組用CO2和NaOH溶液做噴泉實驗的裝置和測得的一組數(shù)據(jù)
以下是某實驗小組用CO2和NaOH溶液做噴泉實驗的裝置和測得的一組數(shù)據(jù)| NaOH濃度(mol/L) | 0 | 0.4 | 0.5 | 0.8 | 1.0 | 1.4 | 1.6 | 1.8 |
| 現(xiàn)象 | 不能 形成 |
一段 液柱 |
形成噴泉 | 形成噴泉 | 形成噴泉 | 形成噴泉 | 形成噴泉 | 形成噴泉 |
| 時間 | 6min | 1min | 35s | 10s | 6s | 6s | ||
| 燒瓶中水的體積(mL) | 7 | 41 | 71 | 125 | 240 | 240 |
| NaOH濃度(mol/L) | 0 | 0.4 | 0.5 | 0.8 | 1.0 | 1.4 | 1.6 | 1.8 |
| 現(xiàn)象 | 不能 形成 |
一段 液柱 |
形成噴泉 | 形成噴泉 | 形成噴泉 | 形成噴泉 | 形成噴泉 | 形成噴泉 |
| 時間 | 6min | 1min | 35s | 10s | 6s | 6s | ||
| 燒瓶中水的體積(mL) | 7 | 41 | 71 | 125 | 240 | 240 |
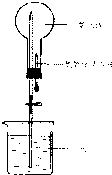
| NaOH濃度(mol/L) | 0.4 | 0.5 | 0.8 | 1.0 | 1.4 | 1.6 | 1.8 | |
| 現(xiàn)象 | 不能 形成 | 一段 液柱 | 形成噴泉 | 形成噴泉 | 形成噴泉 | 形成噴泉 | 形成噴泉 | 形成噴泉 |
| 時間 | 6min | 1min | 35s | 10s | 6s | 6s | ||
| 燒瓶中水的體積(mL) | 7 | 41 | 71 | 125 | 240 | 240 |
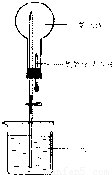
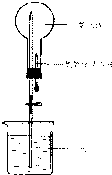 以下是某實驗小組用CO2和NaOH溶液做噴泉實驗的裝置和測得的一組數(shù)據(jù)
以下是某實驗小組用CO2和NaOH溶液做噴泉實驗的裝置和測得的一組數(shù)據(jù)| NaOH濃度(mol/L) | 0 | 0.4 | 0.5 | 0.8 | 1.0 | 1.4 | 1.6 | 1.8 |
| 現(xiàn)象 | 不能 形成 | 一段 液柱 | 形成噴泉 | 形成噴泉 | 形成噴泉 | 形成噴泉 | 形成噴泉 | 形成噴泉 |
| 時間 | 6min | 1min | 35s | 10s | 6s | 6s | ||
| 燒瓶中水的體積(mL) | 7 | 41 | 71 | 125 | 240 | 240 |
| 實驗 序號 |
碳酸鈣 狀態(tài) |
c(HCl)/ mol?l-1 |
溶液溫度/℃ | 碳酸鈣消失 時間/s | |
| 反應前 | 反應后 | ||||
| 1 | 塊狀 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 塊狀 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 塊狀 | 1.0 | 20 | 40 | 120 |
| 6 | 塊狀 | 1.0 | 30 | 50 | 40 |
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com