
ν}ΡΩΝ–±μ(Αϋά®¥πΑΗΚΆΫβΈω)






| Γς |
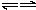 A+EΘ®3Θ©D+EΓζB+C
A+EΘ®3Θ©D+EΓζB+C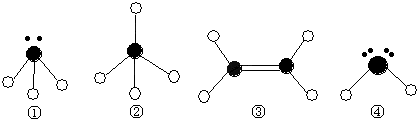


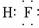
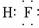


| A | C | |
| B |
ΑΌΕ»÷¬–≈ - ΨöΝïÉ‘Ν–±μ - ‘΅ν}Ν–±μ
Κΰ±± ΓΜΞ¬™(li®Δn)ΨW(w®Θng)Ώ`Ζ®ΚΆ≤ΜΝΦ–≈œΔ≈eàσΤΫ≈_ | ΨW(w®Θng)…œ”–ΚΠ–≈œΔ≈eàσ¨ΘÖ^(q®±) | κä–≈‘pρ_≈eàσ¨ΘÖ^(q®±) | …φöv ΖΧ™üo÷ςΝx”–ΚΠ–≈œΔ≈eàσ¨ΘÖ^(q®±) | …φΤσ«÷ôύ≈eàσ¨ΘÖ^(q®±)
Ώ`Ζ®ΚΆ≤ΜΝΦ–≈œΔ≈eàσκä‘£ΘΚ027-86699610 ≈eàσύ]œδΘΚ58377363@163.com