
題目列表(包括答案和解析)
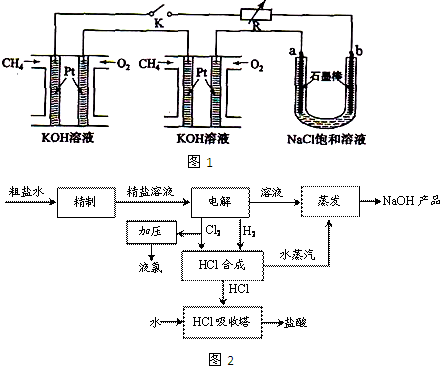
| ||
| ||

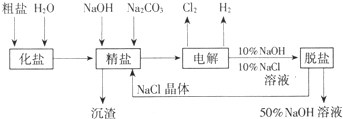 氯堿廠電解飽和食鹽水制取NaOH的工藝流程示意圖:
氯堿廠電解飽和食鹽水制取NaOH的工藝流程示意圖: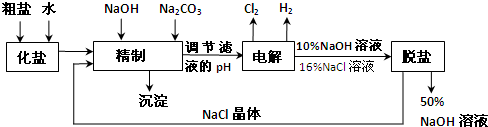
 (2009?廣州模擬)氯堿廠電解飽和食鹽水制取NaOH的工藝流程如下:
(2009?廣州模擬)氯堿廠電解飽和食鹽水制取NaOH的工藝流程如下:
| ||
| ||
| 溫度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| NaOH/g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
| NaCl/g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com