
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�

| ���E | �A�ڬF(xi��n)��ͽYՓ |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
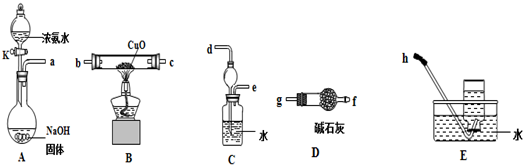
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
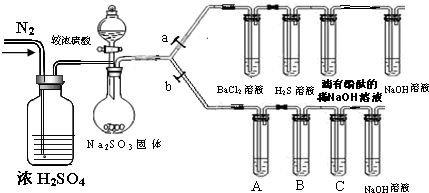
| �μӵ���Һ | ��ˮ | ��ˮ |
| �����Ļ��Wʽ |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
| ���E | �A�ڬF(xi��n)��ͽYՓ |
| ���E1����ʢ�й��wK2Cr2O7��A��B��ԇ���зքe����һ������ϡ���� | |
| ���E2�� | |
| ���E3�� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
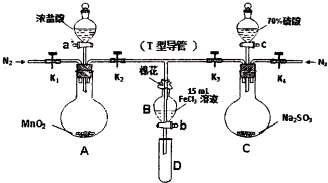
| �^�̢�B��Һ�к��е��x�� | �^�̢�B��Һ�к��е��x�� | |
| �� | ��Fe3+�oFe2+ | ��Fe2+ |
| �� | ����Fe3+����Fe2+ | ��SO42- |
| �� | ��Fe3+�oFe2+ | ��SO42- |
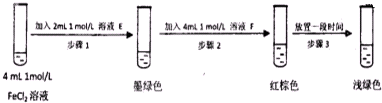
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
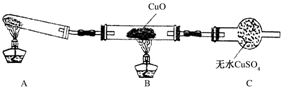
| H+ |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
| 1 |
| 2 |
| 1 |
| 6 |
| a |
| 2 |
�鿴�𰸺ͽ���>>
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙��e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com