(18分)廢舊硬質(zhì)合金刀具中含碳化鎢(WC)��、金屬鈷(Co)及少量雜質(zhì)鐵����,利用電解法回收WC和制備CoxOy,的工藝流程簡(jiǎn)圖如下:
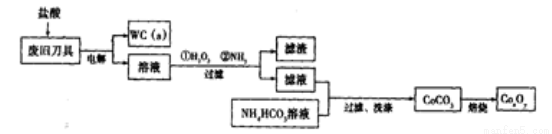
(1)電解時(shí)廢舊刀具作陽(yáng)極�����,不銹鋼作陰極����,鹽酸的作用是______。
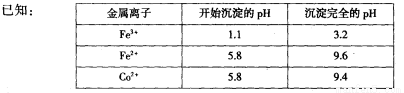
(2)通人氨氣的目的是調(diào)節(jié)溶液的pH���,除去鐵元素��。由表中的數(shù)據(jù)可知���,理論上可選擇pH最大范圍是____________。
(3)實(shí)驗(yàn)測(cè)得NH4HCO3溶液顯堿性�����,制備CoCO3時(shí),選用的加料方式是_______(填代號(hào))��,原因是_______�。
a.將濾液與NH4HCO3溶液同時(shí)加入到反應(yīng)容器中
b.將濾液緩慢加入到盛有NH4HCO3溶液的反應(yīng)容器中
c.將NH4HCO3溶液緩慢加入到盛有濾液的反應(yīng)容器中
寫出生成CoCO3的離子方程式______________________________________��。
(4)實(shí)驗(yàn)中獲得的若洗滌不充分��,在焙燒時(shí)會(huì)產(chǎn)生污染性氣體�����,該污染性氣體的成分為_(kāi)______________(填化學(xué)式)�。
(5)實(shí)驗(yàn)室用下列裝置制取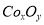 ,并測(cè)定其化學(xué)式����。
,并測(cè)定其化學(xué)式����。
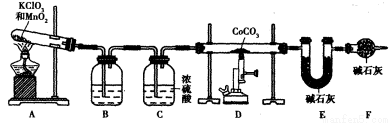
①裝置A制得的中含有少量Cl2,則裝置B中所盛放的試劑為_(kāi)_____(填代號(hào))��。
a.NaHCO3溶液 b.NaOH溶液 c.KMnO4溶液 d.飽和NaCI溶液
②在CoCO3完全轉(zhuǎn)化為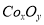 后���,若稱得E管增重4.40g�,D管內(nèi)殘留物質(zhì)的質(zhì)量是8.30g,則生成物
后���,若稱得E管增重4.40g�,D管內(nèi)殘留物質(zhì)的質(zhì)量是8.30g,則生成物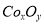 的化學(xué)式為_(kāi)___________����。
的化學(xué)式為_(kāi)___________����。
③若缺少裝置F,則導(dǎo)致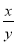 的值______(填“偏大”���、“偏小”或“無(wú)影響”)�。
的值______(填“偏大”���、“偏小”或“無(wú)影響”)�。