【題目】在生活生產(chǎn)中���,鐵的應用非常廣泛���。
(一)認識鐵元素及含鐵物質
(1)人體缺鐵會導致_____(選填序號)。
A 佝僂病 B 貧血癥 C 甲狀腺疾病
(2)鐵與鉻(Cr)�����、鎳(Ni)等金屬熔合可形成“不銹鋼”,用不銹鋼絲和聚乙烯纖維為原料可制作耐酸防護服材料����。以上敘述中不涉及到_____(選填序號)。
A 合金 B 無機非金屬材料 C 合成材料 D 復合材料
(3)冬季取暖人們常用到暖寶寶���,其熱量來源于鐵的緩慢氧化�。已知暖寶寶的主要成分為鐵粉�����、炭粉和少量氯化鈉����,暖寶寶反應的主要原理是鐵粉與氧氣、水共同作用生成氫氧化鐵�����,寫出反應的化學方程式:_____��;氯化鈉的作用是_____�。
(二)制備硫酸亞鐵銨晶體的探究
硫酸亞鐵銨晶體((NH4)aFeb(SO4)c·xH2O)(俗稱摩爾鹽晶體)是一種重要的化工原料,用途十分廣泛�����。某化學實驗小組制備硫酸亞鐵銨晶體并設計實驗測定其組成的流程如下:
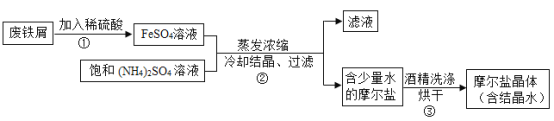
資料:硫酸亞鐵銨晶體易溶于水,不溶于乙醇�����;
(4)實驗前�,先用碳酸鈉溶液浸泡廢鐵屑表面油漬,碳酸鈉溶液可除去油漬是因為碳酸鈉溶液的pH_____7(填“>”����、“=”���、“<”)
(5)操作③中使用乙醇汽油洗滌可以快速晾干�����。這樣做的優(yōu)點是_____�����;
A 避免用水洗滌所造成的晶體損耗
B 酒精易揮發(fā)�,可低溫晾干晶體
C 防止硫酸亞鐵被氧化
(三)硫酸亞鐵銨晶體分解的定性探究
硫酸亞鐵銨晶體受熱分解可得到氧化鐵���。興趣小組在科研人員指導下設計實驗探究硫酸亞鐵銨晶體受熱分解的產(chǎn)物�。
(6)甲組同學設計了如圖1所示實驗裝置:
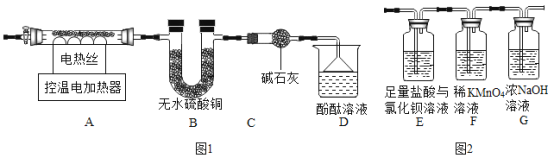
①實驗中,裝置B中觀察到的現(xiàn)象是_____���;
②裝置D中觀察到酚酞溶液變紅色�,由此可知分解的產(chǎn)物中有_____(寫化學式)��。
(7)乙組同學認為硫酸亞鐵銨晶體受熱分解的產(chǎn)物中還有SO2�����、SO3���。為進行驗證����,用甲組實驗中的裝置A和上圖2所示裝置連接進行實驗��。觀察到裝置E中有白色沉淀生成��,證明了有SO3生成��,寫出該反應的化學方程式_____;而F裝置中_____��、表明生成了SO2�����。
(四)硫酸亞鐵銨晶體成分的定量探究
(實驗步驟):取3份質量均為7.84g的(NH4)aFeb(SO4)c·xH2O晶體�����,分別進行實驗�。①向一份中加入過量的NaOH溶液,充分反應后得到0.68gNH3②向另一份中加入過量的BaCl2溶液����,充分反應后過濾、洗滌�、干燥得到9.32g沉淀③加熱第三份晶體使其分解�,剩余固體質量與溫度的關系如圖所示
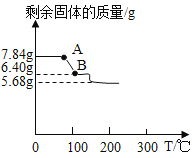
回答下列問題:
資料:硫酸亞鐵銨晶體受熱時,在200℃以下只失去結晶水��。
(8)實驗中加入過量BaCl2溶液的目的_____����;
(9)根據(jù)實驗數(shù)據(jù),計算硫酸亞鐵銨晶體的化學式_____;寫出A點到B點發(fā)生反應的化學方程式_____��。